Chúng ta biết rằng kẽm là yếu tố điều hòa chính đối với chuyển hóa trung gian của các tế bào tuyến tiền liệt, sự thay đổi cân bằng nội môi của kẽm sẽ góp phần phát triển và tiến triển ung thư tiền liệt tuyến. Nồng độ kẽm ở nội bào được điều hòa chặt chẽ bởi hai họ các các chất vận chuyển kẽm, họSLC30 và SLC39. Người ta đã chứng minh rằng ở ung thư tiền liệt tuyến, sự biểu hiện của một số chất vận chuyển kẽm khác biệt so với biểu hiện của chúng ở tình trạng khỏe mạnh và trong tăng sản tuyến tiền liệt lành tính.
1.Tuyến tiền liệt là gì?
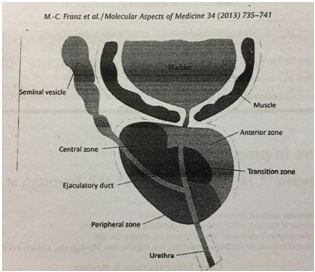
Tuyến tiền liệt là cơ quan ngoại vi của hệ sinh dục nam nằm trong khoang chậu, được bao bọc bởi một lớp cơ xơ mỏng và có thể được chia làm bốn vùng: vùng trước, vùng chuyển tiếp, vùng trung tâm và vùng ngoại vi (Hình 1). Hầu hết tăng sản tuyến tiền liệt lành tính xảy ra ở vùng chuyển tiếp và vùng trung tâm. Vùng ngoại vi, nằm phía dưới cùng và gần với trực tràng, chiếm khoảng 70% tuyến tiền liệt, là nơi phát sinh hầu hết bệnh lý ung thư tiền liệt tuyến. Chức năng chính của tuyến tiền liệt là bài tiết ra dịch tuyến tiền liệt có tính acid nhẹ (pH ~ 6,4) và tạo ra 20% thể tích tinh dịch. Dịch tiết từ tuyến tiền liệt chứa một số yếu tố quan trọng như kẽm, citrate và kháng nguyên đặc hiệu PSA là chất chỉ dấu sinh học ung thư tiền liệt tuyến. PSA là một glycoprotein được tiết bởi tế bào biểu mô tuyến tiền liệt có vai trò chức năng bình thường trong việc tạo ra dạng lỏng của tinh dịch. PSA đi vào máu và sự gia tăng của nó trong tuần hoàn là một chỉ dấu của sự hiện diện ung thư tiền liệt tuyến. Nồng độ PSA trong tuần hoàn tỷ lệ với kích thước của tuyến tiền liệt và có thể tăng lên trong tăng sản tuyến tiền liệt lành tính (BPH).
2. Bệnh ung thư tiền liệt tuyến
Ung thư tiền liệt tuyến có tỷ lệ mắc phải cao thứ hai ở nam giới trên toàn cầu sau ung thư phổi với tỷ lệ tử vong rất cao trong trường hợp bệnh di căn ra bên ngoài (extracapsular disease).Để ngăn ngừa, cùng với thăm khám trực tràng, PSA được sử dụng như là chất chỉ điểm khối u nhằm sàng lọc bệnh. Từ khi bắt đầu việc phát hiện sớm dựa trên PSA, tỷ lệ sống sót tương đối tăng lên rõ rệt, một phần là do được chẩn đoán thường xuyên (Neppl-Huber và cộng sự., 2011). Nguy cơ ung thư tiền liệt tuyến tăng lên theo độ tuổi và tăng cao ở người Mỹ gốc Phi (Rishi et al., 2003).
Ung thư tiền liệt tuyến phát sinh do việc chuyển dạng ác tính của các tế bào tuyến tiền liệt. Loại ung thư thường gặp nhất, chiếm tỷ lệ khoảng 80% các loại ung thư tiền liệt tuyến là ung thư biểu mô tuyến, phát triển từ các tế bào biểu mô tiết của vùng ngoại vi. Thông thường ung thư tiền liệt tuyến có tốc độ phát triển chậm, nhưng có khả năng xâm lấn vào các cơ quan xung quanh như túi tinh, bàng quang hoặc trực tràng. Các tế bào ung thư tiền liệt tuyến lan truyền theo dòng máu và gây ra tình trạng di căn chủ yếu tại hạch bạch huyết và xương.
Hai hệ thống được sử dụng để phân loại ung thư tiền liệt tuyến trên người bệnh. Hệ thống phân loại giai đoạn ung thư TNM đánh giá tình trạng ung thư dựa trên kích thước của u nguyên phát (T), mức độ liên quan tới hạch lymph (N) và dạng di căn (M). Hệ thống phân loại Gleason đánh giá cấu trúc của mô và sự xuất hiện của tế bào, và cho điểm từ 1 đến 5, được thêm vào để cho ra một điểm kết hợp Gleason Sum Score. Điểm cao hơn dự đoán sự tăng trưởng khối u là nghiêm trọng hơn. Hệ thống phân loại này được sử dụng để xác định một tiên lượng và lựa chọn điều trị là sự kết hợp xạ trị, hóa trị, phẫu thuật và liệu pháp hormon.
3. Kẽm đối với sức khỏe con người
Kẽm là một nguyên tố vi lượng thiết yếu phổ biến trong cơ thể người. Nó đóng vai trò quan trọng như một đồng yếu tố (co-factor) của nhiều enzyme và là một thành phần cấu trúc cần thiết ở nhiều protein, như là các yếu tố phiên mã và các enzyme truyền tín hiệu nội bào (Murakami và Hirano, 2008). Kẽm cũng điều hòa các kênh ion màng và các chất vận chuyển, liên quan tới sự dẫn truyền thần kinh ở một số loại tế bào, và ức chế con đường chết theo chương trình của tế bào bằng cách điều hòa hoạt tính của caspaselà họ các enzyme protease đóng vai trò cần thiết trong quá trình tế bào chết theo chương trình(Truong-Tran và cộng sự., 2001). Trong sinh lý học ở người, kẽm có vai trò quan trọng bậc nhất đối với tổng hợp RNA, DNA và quá trình chuyển hóa, do đó đóng vai trò quan trọng trong phân chia tế bào. Vì vậy, kẽm đóng vai trò quan trọng đối với việc sửa chữa mô, lành vết thương, quá trình phát triển và tăng tưởng bình thường, và tạo ra chức năng của hệ miễn dịch, đặc biệt là đối với miễn dịch thu được và không đặc hiệu (Shankar và Prasad, 1998). Cơ thể người chứa 2-4g kẽm, tập trung cao nhất ở tuyến tiền liệt và một số phần của mắt. Nồng độ kẽm trong máu là 15µM, trong đó 85% gắn với carbonic anhydrase ở hồng cầu, phần nhỏ hơn gắn với bạch cầu, albumin và globulin (Dennes et al., 1962). Nồng độ kẽm tự do trong huyết tương và dịch kẽ vào khoảng 200nM (Magneson et al., 1987). Mặc dù tổng lượng kẽm ở nội bào là từ 0,1-0,5 mM, hầu hết liên kết chặt với metalloprotein nội bào, mà chủ yếu là metallothionein và các metalloenzyme khác. Chỉ lượng nhỏ gắn lỏng lẻo với các amino acid hoặc citrate, hoặc biệt lập trong các hốc nội bào. Nồng độ tự do của kẽm trong dịch nội bào nằm trong khoảng từ pM đến fM (Franklin et al., 2005).
Tuyến tiền liệt tích lũy lượng citrate và kẽm cao nhất trong cơ thể. Hàm lượng cao nhất được quan sát thấy ở khoang nội ty thể của các tế bào biểu mô tiết ở vùng ngoại vi. Trong khi các mô mềm khác chứa trung bình 200nmol kẽm/g trọng lượng ướt thì lượng kẽm ở ngoại vi tuyến tiền liệt cao gấp 3-15 lần. Hàm lượng citrate trong ngoại vi tuyến tiền liệt cũng cao gấp 30-50 lần so với tổ chức khác (Franklin et al., 2005b). Chỉ một phần rất nhỏ của kẽm ở nội bào được gắn lỏng lẻo và đóng vai trò như một bể kẽm phản ứng ở các tế bào của động vật có vú. Ở tế bào tuyến tiền liệt, một lượng đáng kể kẽm gắn với lượng lớn citrate làm tăng bể phản ứng di động.
Ý nghĩa sinh lý của sự tích lũy kẽm và citrate tại tuyến tiền liệt
Kẽm ức chế mitochodrial aconitase (m-aconitase), một enzym xúc tác bước đầu tiên của chu trình Krebs, oxy hóa citrate thành isocitrate. Do đó, citrate tích lũy trong bể chứa của tuyến tiền liệt và được tiết vào dịch tuyến tiền liệt. Tác dụng ức chế của kẽm thể hiện ở tất cả các tế bào động vật có vú, nhưng hiệu quả hơn ở các tế bào tuyến tiền liệt. Thậm chí, tác dụng này chỉ được tạo ra bởi các ions kẽm tự do và không được quan sát thấy đối với aconitase của tế bào. Tuy nhiên, kẽm là một chất ức chế cạnh tranh của m-aconitase đối với citrate và việc ức chế chỉ xảy ra khi citrate có vai trò là chất nền (Costello et al., 2000, 1997). Ở các tế bào không phải tuyến tiền liệt trong tình trạng yếm khí, nồng độ kẽm không đủ lớn để ức chế m-aconitase và chu trình Krebs khởi phát để đáp ứng nhu cầu năng lượng chủ yếu. Trong khi citrate là sản phẩm trung gian của chu trình Krebs ở các tế bào yếm khí, ở tế bào tuyến tiền liệtcitrate lại là sản phẩm cuối. Sự cắt ngắn này của chu trình Krebs làm giảm sự cung cấp năng lượng chính của tế bào và gây chết các tế báo yếm khí, nhưng không gây chết tế bào tuyến tiền liệt, đây là đặc điểm độc nhất của tế bào biểu mô tuyến tiền liệt phân biệt với các hiện tượng sinh học đòi hỏi năng lượng lớn khác. Chức năng khác của sự tích lũy kẽm ở mức cao là ức chế sự tăng sinh và kích thích quá trình chết theo chương trình (Feng et al., 2002). Kẽm tác động trực tiếp trên ty thể, gây ra việc phóng thích cytochrome c làm kích hoạt hệ thống enzyme caspase dẫn đến kích thích quá trình chết theo chương trình(Franklin và Costello, 2007). Hiệu ứng này được điều hòa bởi gene Bax có ở màng ngoài của ty thể. Kẽm tạo thuận lợi cho quá trình hình thành các nang chứa Bax cũng như làm tăng Bax ở tế bào (Feng et al., 2008). Liang và cộng sự đã xác định rằng kẽm kích thích giai đoạn nghỉ của chu kỳ tế bào ở phase G2/M (Liang et al., 1999).
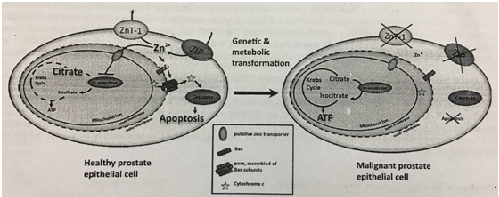
Nồng độ kẽm và citrate cao là đặc điểm của các tế bào tuyến tiền liệt khỏe mạnh ở khu vực ngoại vi. Ở bệnh nhân tăng sản tuyến tiền liệt lành tính, nồng độ thậm chí tăng nhẹ, trong khi ở bệnh nhân ung thư tuyến tiền liệt nồng độ kẽm và citrate giảm dưới mức bình thường, đôi khi giảm xuống mức độ không thể phát hiện. Sự suy giảm của kẽm tương quan với điểm Gleason và rõ ràng hơn ở trường hợp bệnh tiến triển (Cortesi et al., 2010). Nồng độ kẽm giảm xuống có hai tác động chính lên tế bào tuyến tiền liệt: tác động chuyển hóa và phát triển. Tác dụng ức chế m-aconitase ngừng lại khi nồng độ kẽm giảm xuống, do đó cho phép oxy hóa citrate và sản xuất ATP. Kết quả là, trái ngược với các tế bào khỏe mạnh không phụ thuộc năng lượng, sản xuất citrate, các tế bào ác tính trở nên phụ thuộc năng lượng (Hình 2). Khả năng mà nồng độ hoặc biểu hiện của enzyme m-aconitase biến đổi trong quá trình chuyển dạng ác tính đã bị loại trừ; nồng độ enzyme không thay đổi nhưng hoạt tính của chúng lại tăng lên (Singh và cộng sự., 2006). Tác động gây tăng trưởng của nồng độ kẽm nội bào thấp là kết quả của việc loại bỏ tác dụng hỗ trợ tế bào chết theo chương trình của kẽm. Cùng với việc sản xuất năng lượng tăng lên, tác động gây tăng trưởng sẽ thúc đẩy tăng sinh của tế bào ác tính (Costello et al., 2004). Tuy nhiên, hiệu lực của kẽm mang tính đặc trưng theo tế bào và phụ thuộc vào nồng độ.
4. Các họ chất vận chuyển kẽm SLC30 và SLC39
Cân bằng nội môi của kẽm trong tế bào được điều hòa chặt chẽ bởi các chất vận chuyển kẽm có trong huyết tương và màng nội bào. Hai họ chính của chất vận chuyển kẽm là SLC39 (các protein tương tự Zrt và Irt, ZIP) và SLC30 (ZnT). Những họ chất vận chuyển này biểu lộ chức năng đối lập trong việc vận chuyển kẽm ở tế bào. Trong khi các protein SLC39 làm tăng nồng độ kẽm ở bào tương nội bào bằng cách lấy kẽm từ dịch ngoại bào hoặc từ các túi nội bào, thì các protein SLC30 làm giảm nồng độ kẽm ở bào tương nội bào bằng cách vận chuyển kẽm ra ngoài tế bào hoặc đi vào các túi nội bào (Eide, 2004; Liuzzi và Cousins, 2004; Palmiter và Huang, 2004).
5. Sự biến đổi của các chất vận chuyển kẽm ở bệnh ung thư tiền liệt tuyến
Như đã trao đổi ở trên, nồng độ kẽm cao là cần thiết cho sự khỏe mạnh của tuyến tiền liệt, và hàm lượng kẽm ở mô ung thư rất thấp hoặc không đáng kể. Bởi vậy, việc tìm ra cơ chế các tế bào tuyến tiền liệt tích lũy nồng độ kẽm cao một cách đáng kể, và các yếu tố vận chuyển/ bảo vệ bị loại bỏ trong bệnh ung thư tiền liệt tuyến là rất quan trọng. Có một số chất vận chuyển kẽm dường như bị tác động hoặc liên quan đối với sự tiến triển của bệnh ung thư tiền liệt tuyến.
Protein ZIP1, mã hóa bởi SLC39A1, được tìm thấy biểu hiện ở màng bên của tế bào biểu mô tuyến tiền liệt, nhưng không có trong mô bị xơ hóa. Ở tế bào biểu mô tuyến tiền liệt, ZIP1 được coi là chất vận chuyển hấp thụ kẽm chính liên quan đến việc tách kẽm từ máu. Sự biểu hiện của SLC39A1 được phát hiện là giảm một cách đáng kể hoặc không có trong bệnh ung thư tiền liệt tuyến so với tuyến tiền liệt bình thường hoặc mô tăng sản tuyến tiền liệt lành tính (Franklin et al., 2005; Johnson et al., 2010).
Trong mô hình ung thư biểu mô tuyến tiền liệt của chuột do chuyển gen (TRAMP), nồng độ citrate và kẽm giảm và protein ZIP1 biến mất ở các khối u TRAMP (Costello et al., 2011). Hơn nữa, biểu hiện protein của ZIP1 thấp hơn ở những tế bào tuyến tiền liệt mang khối u ở người RWPE2 khi so sánh với những tế bào không mang khối u RWPE1 (Huang et al., 2006). Điều thú vị là ZIP1 được biểu hiện ở LNCaP và PC-3, những dòng tế bào ác tính có nguồn gốc từ các mô ung thư tiền liệt tuyến di căn, chứng tỏ rằng sự không có biểu hiện của ZIP1 ở các tuyến ác tính tại chỗ không phải do sự mất đoạn hoặc đột biến nghiêm trọng của gene (Franklin et al., 2005, 2003). Ở những tế bào này, ZIP1 được cho thấy là con đường hấp thụ kẽm chủ yếu. Ngoài ra, có sự tương quan chặt chẽ đã được chỉ ra giữa nồng độ kẽm và biểu hiện của ZIP1 ở tuyến tiền liệt. Trong quá trình tiến triển của bệnh ung thư tiền liệt tuyến, sự giảm biểu hiện của ZIP1 và suy giảm kẽm xảy ra vào những giai đoạn sớm của bệnh.
Ở mô tuyến tiền liệt khỏe mạnh, ZIP2 có ở màng đỉnh của tế bào biểu mô, trái ngược với mô xơ hóa không có protein này. Dựa vào vị trí của nó, ZIP2 được giả thiết là tham gia vào việc duy trì cân bằng nội môi của kẽm trong tế bào bằng cách tái hấp thu kẽm từ dịch tuyến tiền liệt (Desouki et al., 2007). Người ta đã chứng minh rằng sự vận chuyển kẽm bởi ZIP2 không phụ thuộc vào năng lượng, điện thế màng và Na+. Ngược lại, hoạt lực vận chuyển được tăng lên bởi sự tăng pH (sự ức chế xảy ra ở pH dưới 7.0) hoặc bởi HCO3– (Gaither và Elide, 2000). Các nghiên cứu gần đây cho thấy rằng ZIP2 bị giảm xuống trong bệnh ung thư tiền liệt tuyến, trong khi đó lại hiện diện nhiều ở các tế bào biểu mô tuyến tiền liệt bình thường và tăng sản tuyến tiền liệt lành tính (Desuki et al., 2007). Ngoài ra, sự biểu hiện của ZIP2 được phát hiện là thấp hơn đáng kể ở những bệnh nhân người Mỹ gốc Phi, những người thường có khả năng bị ung thư tiền liệt tuyến cao hơn so với những người da trắng có cùng độ tuổi. Hơn nữa, nồng độ ZIP2 ở các mẫu mô của người Mỹ gốc Phi thấp hơn so với những mẫu có cùng điểm Gleason của những người da trắng (Rishi et al., 2003).
Một thành viên khác của họ protein vận chuyển SLC39 liên quan với bệnh ung thư tiền liệt tuyến là ZIP3, mã hóa bởi SLC39A3. Giống như ZIP2, ZIP3 có ở màng đỉnh của tế bào biểu mô tuyến tiền liệt và có thể có chức năng tương tự: tái hấp thu kẽm từ dịch tuyến tiền liệt. Cùng với ZIP2, biểu hiện protein của ZIP3 cũng giảm xuống ở bệnh ung thư tiền liệt tuyến (Desouki và cộng sự., 2007). Người ta cũng thấy rằng, biểu hiện protein thay đổi cùng với tình trạng của kẽm, trong khi biểu hiện của mRNA không bị ảnh hưởng, cho thấy vai trò điều hòa hậu dịch mã của protein này (Wang và cộng sự., 2004). Đáp ứng với kẽm, ZIP3 được tái phân bố ở mức độ đáng kể từ màng tế bào tới các khoang lysosom ở dòng tế bào mang khối u RWPE2 so với dòng tế bào tuyến tiền liệt không mang khối u RWPE1, cho thấy sự suy giảm mạnh của protein này (Huang et al., 2006).
ZIP4 có tại màng đỉnh của tế bào ở đường ruột của chuột, và sự đột biến của gene SLC39A4 mã hóa ZIP4 ở người được phát hiện có liên quan chặt chẽ với bệnh vảy nến nguyên nhân đường ruột, là tình trạng di truyền hiếm gặp mà nguyên nhân là do khiếm khuyết hấp thu kẽm tại đường ruột (Schmitt et al., 2009). Tuy nhiên, ZIP4 cũng có mặt tại tế bào biểu mô tuyến tiền liệt (Chen et al., 2011). Hiện nay, đã có báo cáo về sự suy giảm mRNA và biểu hiện protein của SLC39A4 ở bệnh ung thư tiền liệt tuyến so với tăng sản tuyến tiền liệt lành tính (BPH). Tuy nhiên, người ta cũng thấy rằng không có sự tương quan giữa phân độ ung thư và mức độ biểu hiện của ZIP4 (Chen et al., 2011). Điều này nhấn mạnh thực tế rằng sự thay đổi của kẽm và citrate xảy ra sớm trong quá trình phát triển ác tính và duy trì trong quá trình tiến triển của bệnh. Ngoài ra, hiệu quả ức chế in vitrolên sự tăng sinh và xâm lấn đã được chứng minh ở tế bào ung thư nếu có sự hiện diện của chất vận chuyển (Chen et al., 2011).
Chưa biết nhiều về sự tham gia có thể có của các chất vận chuyển kẽm ngược dòng, họ SLC30, trong sự chuyển dạng ác tính của tuyến tiền liệt. Sự biểu hiện của SLC30A1 mRNA mã hóa ZnT-1 được phát hiện là giảm (Hasumi et al., 2003) hoặc không đổi ((Beck et al., 2004), Freeman, Suzuki và Hediger, dữ liệu không công bố) ở các mẫu ung thư tiền liệt tuyến so với các mô tăng sản tuyến tiền liệt lành tính. Ở RPWE1, dòng tế bào tuyến tiền liệt bất tử, không mang khối u, ZnT-1 cũng biểu hiện ít hơn so với những dòng tế bào ung thư tuyến tiền liệt di căn lớn như PC-3 và DU-145 (Albrecht et al., 2008). Mức độ mRNA của SLC30A4, mã hóa ZnT-4, cũng giảm ở bệnh ung thư tiền liệt tuyến so với các mẫu mô tuyến tiền liệt bình thường (Beck et al., 2004; Heeshall et al., 2003), nhưng đã quan sát thấy có sự tăng từ các mẫu ung thư tuyến tiền liệt so với các mẫu tăng sản tuyến tiền liệt lành tính (Freeman, Suzuki và Hediger, dữ liệu không công bố). Mức ZnT-1 được quan sát là bình thường ở tăng sản tuyến tiền liệt lành tính và giảm trong bệnh ung thư (Beck et al., 2004; Hasumi et al., 2003). Tuy nhiên, quan sát không công bố của chúng tôi cho thấy rằng mức ZnT-1 tăng khoảng 7 lần so với mức mRNA. ZnT-4 có tại màng tế bào cũng như trong các túi nội bào (Henshall et al., 2003). Những dữ liệu này cho thấy rằng sự thay đổi biểu hiện của ZnT-4 liên quan tới sự bất thường của mô tuyến tiền liệt độc lập với nồng độ của kẽm ở tuyến tiền liệt. Hơn nữa, mức độ mRNA của SLC30A5, mã hóa ZnT-5, tăng lên ở bệnh ung thư tuyến tiền liệt so với các mẫu tăng sản tuyến tiền liệt lành tính (xem Bảng 1; Freeman, Suzuki và Hediger, dữ liệu không công bố).
Phân tích dữ liệu biểu hiện từ các dữ liệu công bố tại http://www.ncbi.nlm.nih.gov/geo/ tiếp cận qua thông số GSE17951 cho thấy biểu hiện của SLC39A6, SLC39A7, SLC39A8, SLC30A5, SLC30A7 và SLC30A9 tăng lên trong khi SLC39A14 giảm trong bệnh ung thư tiền liệt tuyến (Jia và cộng sự., 2011; Wang và cộng sự., 2010).
6. Quan điểm
Như đã trao đổi ở trên nồng độ kẽm ở tuyến tiền liệt suy giảm nghiêm trọng ở bệnh ung thư tiền liệt tuyến. Điều này dẫn tới giả thiết rằng sự hồi phục nồng độ kẽm cao sẽ đảo ngược kiểu hình ác tính của tế bào và/ hoặc thúc đẩy hiện tượng tế bào chết theo chương trình. Nồng độ kẽm có thể hồi phục bằng cách hoặc làm tăng nồng độ kẽm trong vòng tuần hoàn, tăng hấp thu kẽm từ vòng tuần hoàn, hoặc làm giảm hiện tượng bơm ngược kẽm từ tế bào ra ngoài. Phương pháp đơn giản nhất là tăng khả dụng sinh học của kẽm bằng cách tăng hấp thu theo chế độ ăn, nhưng kết quả từ các nghiên cứu này không nhất quán và đã có báo cáo thận trọng, không có hiệu quả, thậm chí là có hại (Costello et al., 2005). Phương pháp khác là làm biến đổi biểu hiện của các chất vận chuyển kẽm bằng liệu pháp điều trị hormon. Người ta thấy rằng testosterone và prolactin có thể làm tăng biểu hiện của ZIP1 (Costello et al., 1999), nhưng vai trò gia tăng của các chất vận chuyển hấp thu kẽm khác cũng nên được xem xét. Mặc dù lĩnh vực nghiên cứu chất vận chuyển kẽm đã phát triển đáng kể trong những năm qua, những câu hỏi quan trọng vẫn cần giải đáp thông qua các cách tiếp cận như phát triển đích đặc hiệu đối với mô của các chất vận chuyển, và kích hoạt chất vận chuyển hóa chất đặc hiệu. Tóm lại, vai trò trung tâm của việc suy giảm nồng độ kẽm ở tuyến tiền liệt trong giải đoạn tiến triển của bệnh ung thư tiền liệt tuyết đã được chứng minh rõ ràng. Mặc dù có sự liên quan của một số chất vận chuyển kẽm, những tín hiệu điều hòa đối với sự phát triển khối u và cơ chế của nó vẫn cần phải được làm sáng tỏ. Những nghiên cứu sâu hơn là cần thiết để cải thiện đích dược lý của các chất vận chuyển kẽm.
M.-C. Franz, P. Anderle, M. Burzle, Y. Suzuki, M.R. Freeman, M.A. Hediger
(Ths.Ds. Ngô Trí Diễm dịch và giới thiệu)
https://www.sciencedirect.com/science/article/pii/S0098299712001343



Đặt khám để nhận chính sách tốt nhất
Lý do bạn nên chọn Bệnh viện Ung Bướu Nghệ An
Đội ngũ y bác sỹ giỏi, giàu kinh nghiệm
Hệ thống trang thiết bị đầy đủ hiện đại
Chăm sóc bệnh nhân tận tình chu đáo
Thủ tục nhanh gọn, dễ dàng
Chi phí khám chữa bệnh hợp lý
Cập nhật áp dụng kỹ thuật điều trị tân tiến
BÁC SĨ: 0919180014